钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。
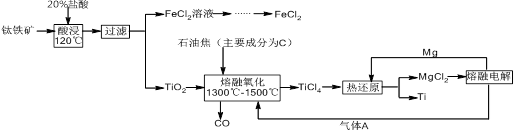
(1)请写出FeTiO3与稀盐酸反应的离子方程式: 。
(2)请写出“熔融氧化”的化学方程式: 。
(3)电解氯化镁的阴极反应式为: ,可循环利用的物质为: (填化学式)。
(4)热还原法中能否改用钠代替镁作还原剂: (填“能”或“不能”);原因为: 。
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是 (填化学式)。
(1)FeTiO3+2H+  Fe2++TiO2+H2O (3分)
Fe2++TiO2+H2O (3分)
(2)TiO2+ 2C+ 2Cl2  TiCl4+ 2CO (3分)
TiCl4+ 2CO (3分)
(3)Mg2+ + 2e- =" Mg" (3分) Cl2和Mg (2分)
(4)能;(1分)钠的还原性比镁强(1分)
(5)HCl(2分)(填写H2SO4、HNO3均可)
题目分析:由已知条件可知,金属Ti是难溶于稀硫酸和稀盐酸的物质,而杂质MgCl2和Mg都是易溶于酸的,所以要除去杂质,可以加入稀盐酸或稀硫酸等试剂。
(1)根据流程图示,钛铁矿中加入盐酸酸浸后,得到了滤液氯化亚铁和滤渣TiO2,所以根据反应物和产物可以写出反应的离子方程式为:FeTiO3+2H+  Fe2++TiO2+H2O。
Fe2++TiO2+H2O。
(2)熔融氧化过程中参与反应的物质已知的有TiO2和C,从产物来看C作了还原剂被氧化成了CO,但是TiO2生成TiCl4,Ti的化合价没有发生变化,且多出了Cl离子,所以由此可以猜测还有一种氧化剂参与了反应,而氧化剂就是氯气,所以根据所推反应物和生成物,该反应的化学方程式为:TiO2+ 2C+ 2Cl2  TiCl4+ 2CO。
TiCl4+ 2CO。
(3)电解氯化镁可以制备金属镁,所以阴极发生的反应式为Mg2+ + 2e- = Mg,而阳极发生氧化反应生成氯气,电解产生的金属镁、氯气可以分别在热还原步骤和熔融氧化步骤中加以循环利用。
(4)热还原是在高温的条件下用活泼金属还原制备较不活泼金属的过程,金属钠比金属镁更加活泼,所以也可以用金属钠代替金属镁做还原剂。
