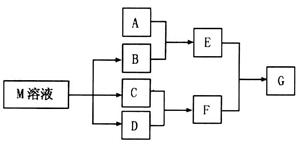
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式 。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是 。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是 。
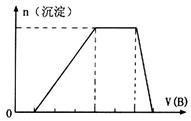
(5)若A是一种溶液,只可能含有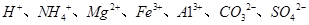 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
(1)2Cl‾+2H2O 2OH‾+H2↑+Cl2↑(2分)
2OH‾+H2↑+Cl2↑(2分)
(2)H2SiO3(1分)
(3)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失(1分)
(4)4Fe2++8OH‾+O2 +2H2O = 4Fe(OH)3↓(2分)
(5)c(H+):c(Al3+):c(NH4+):c(SO42‾)=1:1:2:3(2分,推断出前三种且结果正确得1分)
题目分析:C可在D中燃烧发出苍白色火焰,可知二者分别为H2、Cl2,F为HCl,物质M是一种日常生活中不可缺少的调味品,为NaCl,则B为NaOH 。
(1)用惰性电极电解NaCl溶液,生成NaOH、H2、Cl2,离子方程式为:
2Cl‾+2H2O 2OH‾+H2↑+Cl2↑
2OH‾+H2↑+Cl2↑
(2)若A是一种酸性氧化物,且可用于制造玻璃,则A为SiO2,与NaOH反应生成的E为Na2SiO3,与HCl反应生成的G为H2SiO3。
(3)A是一种常见金属单质,能与NaOH溶液反应,则A为Al,E为Na[Al(OH)4],将过量的盐酸逐滴加入Na[Al(OH)4]溶液,边加边振荡,Na[Al(OH)4]先与HCl反应生成Al(OH)3,继续加入HCl,Al(OH)3与HCl反应生成AlCl3,所以实验现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。
(4)A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A中含Fe2+,生成的E为Fe(OH)3,发生的反应有:Fe2++2OH‾=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,两步反应加和可得离子方程式:4Fe2++8OH‾+O2 +2H2O = 4Fe(OH)3↓
(5)根据图像,设图像中加入单位体积的NaOH溶液含NaOH为1mol,加入第一部分NaOH没有沉淀生成,发生的反应为:OH‾+H+=H2O,则原溶液含H+,物质的量为1mol;继续加入3mol NaOH生成沉淀,最后加入1mol NaOH,Al(OH)3溶解,则原溶液含Al3+,物质的量为1mol;则Mg2+、Fe3+、CO32‾一定不存在;中间加入2mol NaOH,沉淀不变,发生的反应为OH‾与NH4+反应,则原溶液含NH4+,物质的量为2mol,阴离子只能为SO42‾,根据电荷守恒可得SO42‾的物质的量为3mol,所以c(H+):c(Al3+):c(NH4+):c(SO42‾)=1:1:2:3
