下列关于常温下电解质溶液的叙述中,正确的是
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应: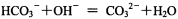
B.向一定体积一定物质的量浓度的氨水中滴加盐酸,所得溶液一定存在:c(H+)+c(NH4+)=c(Cl‾)+c(OH‾)
C.标准状况下4.48L二氧化碳气体通入到2L0.15mol•L‾1的NaOH溶液中,离子浓度大小顺序为:c(Na+) > c(CO32‾) > c(OH‾) >c(HCO3‾) > c(H+)
D.pH=8的0.1 mol·L-l CH3COONa溶液中由水电离出的c(OH‾)=1.0×10-8mol•L‾1
答案:B
题目分析:A、NaOH为足量,则OH‾与碳酸氢铵溶液中的HCO3‾、NH4+都发生反应,错误;B、不论氨水和盐酸量的多少,二者反应后的溶液一共含有4种离子:H+、NH4+、Cl‾、OH‾,根据电荷守恒可得关系式:c(H+)+c(NH4+)=c(Cl‾)+c(OH‾),正确;C、CO2的物质的量为0.2mol,NaOH的物质的量为0.3mol,发生两个反应:CO2+2NaOH=Na2CO3+H2O和CO2+NaOH=NaHCO3,根据化学方程式可得完全反应后生成的Na2CO3为0.1mol,NaHCO3为0.1mol,因为CO32‾的水解程度大于HCO3‾的水解程度,所以溶液中离子浓度大小顺序为:c(Na+) > c(HCO3‾)> c(CO32‾) > c(OH‾) > > c(H+),错误;D、CH3COONa溶液中OH‾来源于H2O的电离,因为pH=8,则c(OH‾)=10-6mol•L‾1,所以pH=8的0.1 mol·L-l CH3COONa溶液中由水电离出的c(OH‾)=1.0×10-6mol•L‾1,错误。
