(14分)二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②检验TiO2·xH2O中Cl-是否被除净的方法是 。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
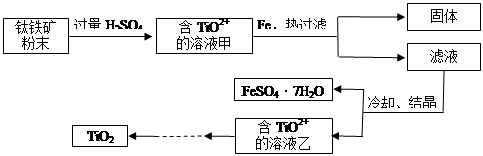
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ、二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
TiO2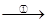 TiCl4
TiCl4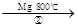 Ti
Ti
反应②的方程式是 ,该反应需要在Ar气氛中进
行,请解释原因: 。
(14分,每空2分)
(1)①TiCl4 + (x + 2)H2O(过量) TiO2·xH2O↓ + 4HCl(写=不扣分)
TiO2·xH2O↓ + 4HCl(写=不扣分)
②取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已洗净。
(2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O
(3)Fe3+、Fe2+
(4)将Fe3+转化为Fe2+
(5)TiCl4 + 2Mg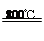 2MgCl2 + Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用。
2MgCl2 + Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用。
题目分析:(1)①TiCl4水解生成TiO2·xH2O和氯化氢,根据元素守恒规律书写其化学方程式为
TiCl4 + (x + 2)H2O(过量) TiO2·xH2O↓ + 4HCl;
TiO2·xH2O↓ + 4HCl;
②检验沉淀是否被洗干净的方法是取少量洗涤后的溶液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已洗净。
(2)Fe2O3与H2SO4发生反应生成硫酸铁和水,氧化铁是氧化物,不能拆开,硫酸是强酸,写成离子形式,所以离子方程式为Fe2O3 + 6H+ = 2Fe3+ + 3H2O ;
(3)FeTiO3中Ti元素化合价为+4价,则Fe为+2价,钛铁矿中含有氧化铁,所以甲溶液中除iO2+之外还含有的金属阳离子有Fe3+、Fe2+
(4)加Fe的作用是将Fe3+转化为Fe2+,便于Fe2+结晶为FeSO4·7H2O
(5)TiCl4与Mg在800℃发生置换反应生成钛和氯化镁,化学方程式为TiCl4 + 2Mg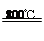 2MgCl2 + Ti;
2MgCl2 + Ti;
Mg与Ti在高温条件下易与空气中的氧气、二氧化碳发生反应,所以为了防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用,该反应需要在Ar气氛中进行。
