(15分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3的流程图如下。

(1)碱性锌锰干电池的负极材料是 (填化学式)。
(2) 第I步操作得滤渣的成分是 ;第Ⅱ步操作的目的是 。
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为 。
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为 。
(已知:Ksp(MnS)=2.5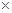 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6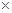 10-24)
10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,l00oC时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7; 操作2:过滤,用少量水洗涤2~3次;
操作3:检测滤液; 操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①试剂X是 ;
②操作3中,说明SO42-已除干净的方法是 。
(1)Zn。(2)MnO2和炭粉;除去炭粉。(3)MnO2+H2O2+H2SO4 MnSO4+2O2+H2O;
MnSO4+2O2+H2O;
(4)MnS+Zn2+ ZnS+Mn2+。(5)①Na2CO3;②取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
ZnS+Mn2+。(5)①Na2CO3;②取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
题目分析:根据题给信息和工艺流程知,黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,MnO2和炭粉不溶于水,经水浸、过滤、洗涤得滤渣的成分是MnO2和炭粉;MnO2和炭粉加热至恒重,碳粉与空气中的氧气反应生成碳的氧化物而除去,黑色物质M的主要成分为MnO2,MnO2与硫酸、双氧水反应生成硫酸锰、氧气和水,经过系列操作的高纯MnCO3。(1)根据教材知识知,碱性锌锰干电池的负极材料是Zn。(2) 由上述分析知,第I步操作得滤渣的成分是MnO2和炭粉;第Ⅱ步操作的目的是除去炭粉。(3)MnO2与硫酸、双氧水反应生成硫酸锰、氧气和水,该反应的化学方程式为MnO2+H2O2+H2SO4 MnSO4+2O2+H2O。(4)由Ksp(MnS)=2.5
MnSO4+2O2+H2O。(4)由Ksp(MnS)=2.5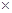 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6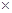 10-24知,ZnS比MnS更难溶,利用沉淀的转化除去Zn2+的离子方程式为MnS+Zn2+
10-24知,ZnS比MnS更难溶,利用沉淀的转化除去Zn2+的离子方程式为MnS+Zn2+ ZnS+Mn2+。 (5)第V步系列操作由硫酸锰制得高纯MnCO3。①试剂X是Na2CO3;②操作3为检验沉淀是否洗涤干净,说明SO42-已除干净的方法是取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
ZnS+Mn2+。 (5)第V步系列操作由硫酸锰制得高纯MnCO3。①试剂X是Na2CO3;②操作3为检验沉淀是否洗涤干净,说明SO42-已除干净的方法是取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
