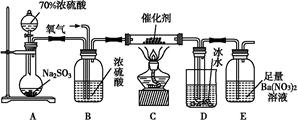
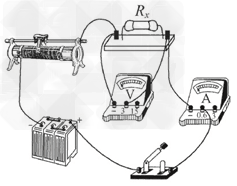
在“伏安法测定值电阻”的实验中,小明同学所用的电源电压恒定不变,但电源电压未知,滑动变阻器标有“20 Ω 1.5 A”字样,电压表和电流表的量程合适,但已连接了部分电路,如图甲所示. 请你接着完成下列问题:
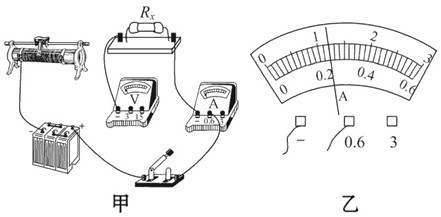

(1)用笔画线代替导线,将图甲中的电路连接完整.
(2)当电压表示数为2.4 V时,电流表的示数如图乙所示,则其示数为______A,电阻丝的电阻为_______Ω.
(3)进行了上步计算后,小明认为实验就完成了,小亮则认为,仅这样就得出电阻的阻值不够可靠.原因是____________________________________________.
(4)小芳连接电路后,闭合开关,移动滑动变阻器滑片的过程中发现,电流表示数变大时,电压表示数反而减小,电流表示数变小时,电压而增大.经检查所用器材均完好.你认为出现上述实验现象的原因是________________.
(5)小芳正准备继续实验,发现电压表已损坏.她利用余下的电流表和滑动变阻器完成对Rx的再一次测量.请你在图丙中画出设计的电路图,并完善下列步骤.
①按照电路图连接好电路;
②调节滑动变阻器的滑片,使接入电路的阻值为_________时,读出电流表的示数I1;
③再调节滑动变阻器的滑片,使接入电路的阻值为________时,读出电流表的示数I2;
④根据已知条件和测量结果,写出定值电阻的表达式:Rx=_________.
(1)
(2)0.24 ; 10
(3)为减小误差,应多次测量求平均值
(4)电压表并联在滑动变阻器两端了
(5)①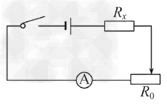
②0
③最大值R0
④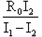

 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。