X、Y、Z为不同短周期非金属元素的气态单质.在一定条件下能发生如下反应:Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成离子化合物,甲的相对分子质量小于乙.
(1)X的结构式是______.
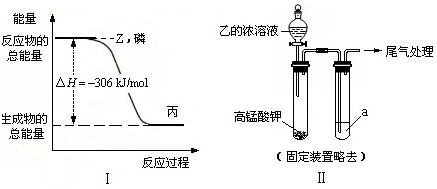
(2)磷在Z气体中燃烧可生成液态丙分子,也可生成固态丁分子.已知丙分子中各原子最外层均是8电子结构,丙的电子式是______.磷单质和Z单质反应生成1mol丙时,反应过程与能量变化如图Ⅰ所示,该反应的热化学方程式是______.
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是______的水溶液.若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是______.
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由X.Y.Z|中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是______、______.
X、Y、Z为不同短周期非金属元素的气态单质,Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成离子化合物,则该化合物为NH4Cl,甲的相对分子质量小于乙,则甲为NH3,乙为
HCl,Y为H2,X为N2,Z为Cl2,
(1)X为N2,氮原子之间有3对共用电子对,结构为N≡N,故答案为:N≡N;
(2)P在氯气中燃烧可生成PCl3或PCl5,其中PCl3分子中各原子最外层均是8电子结构,电子式为

,
根据图象可知 P(s)+
Cl2(g)总能量大于1molPCl3的能量,反应放热,所以热化学方程式为:3 2
P(s)+
Cl2(g)=PCl3(l);△H=-306 kJ/mol,3 2
故答案为:

; P(s)+
Cl2(g)=PCl3(l);△H=-306 kJ/mol;3 2
(3)氯气的氧化性大于碘的氧化性,将氯气通入淀粉KI溶液中生成碘单质,溶液变蓝,氯气具有强氧化性,与过量氨气反应生成NH4Cl和N2,反应的方程式为8NH3+3Cl2=6NH4Cl+N2,
故答案为:淀粉KI或KI;8NH3+3Cl2=6NH4Cl+N2;
(4)若在通入SO2气体的同时加入Cl2,发生反应为SO2+Cl2+2H20═H2SO4+2HCl,在BaCl2溶液中生成BaSO4沉淀,若在通入SO2气体的同时加入NH3,溶液中存在大量的SO3-,可生成沉淀
BaSO3,故答案为:Cl2; NH3.
