直接排放含SO2,的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2在钠碱循环法中,用Na2SO3溶液作为吸收液,吸收液吸收SO2的过程中,pH随n(SO32-): n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a. c(Na+ )=" 2c(" SO32-) + c( HSO3-)
b. c(Na+ )> c( HSO3-)>c( SO32-) >c(H+)>c(OH-)
c. c(Na+ )+ c(H+)="c(" HSO3-)+c( SO32-) +c(OH-)
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
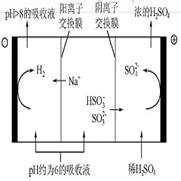
(3)HSO3-在阳极放电的电极反应式是_________________________________________
(4)当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________
(1)酸;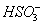 存在;
存在;
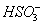 的电离程度强于水解强度
的电离程度强于水解强度
(2)a (3)
(4)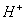 在阴极得电子生成
在阴极得电子生成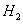 ,溶液中
,溶液中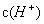 降低,促使
降低,促使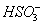 电离生成
电离生成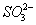 ,且
,且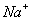 进入阴极室,使吸收液再生
进入阴极室,使吸收液再生
题目分析:(1)由表给数据n(SO32—):n(HSO3—)=1:1时,溶液PH=7.2,可知溶液显酸性,这说明HSO3—的水解程度小于HSO3—的电离程度,所以溶液显酸性。
(2)收液显中性必然是亚硫酸钠和亚硫酸钠的混合液,溶液中电荷守恒的关系为:c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—),由此可判断a正确,b、c不正确。
(3)阳极发生氧化反应,所以HSO3—在阳极失去电子生成SO42—和H+。
(4)阴极H+放电破坏水的电离平衡,溶液中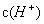 降低,促使
降低,促使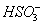 电离生成
电离生成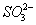 ,且
,且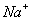 进入阴极室,使吸收液得以再生并循环使用。
进入阴极室,使吸收液得以再生并循环使用。
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力。该题通过陌生情景考查学生对图表的观察、分析以及学生对实验数据的分析、整理、归纳等方面的思维能力,难度较大。
