问题
选择题
现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四种溶液:①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是( )
A.pH由小到大的顺序是①< ②< ③< ④
B.溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③
C.取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③
D.取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9
答案
答案:D
题目分析:盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,氢氧化钠是一元强碱,所以在物质的量浓度相等的条件下,pH由小到大的顺序是②<①<③<④,A不正确;酸或碱溶液中氢离子或OH-浓度越大,对的水的电离程度抑制纯度越大,则溶液中水电离出的H+浓度由小到大的顺序是②<①=④<③,B不正确;C不正确,消耗三种酸的溶液体积由小到大的顺序是②<①=③;D中反应后盐酸是过量的,则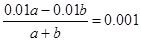 ,解得a:b=11:9,D正确,答案选D。
,解得a:b=11:9,D正确,答案选D。
点评:该题是中等难度的试题,试题贴近高考,紧扣教材。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。该题的关键是明确弱电解质的电离平衡特点以及pH计算的依据,然后结合题意灵活运用即可。
