已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,A是一种大气污染物,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子.反应中部分生成物已略去.试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是(用化学式表示)______;
(2)写出C原子的电子排布式______,B在生活中的一种用途是______;
(3)写出反应③的化学方程式______;
(4)若将X加入B和稀硫酸的混合液后发现X溶解,溶液呈无色并产生气泡,写出反应的离子方程式:______.
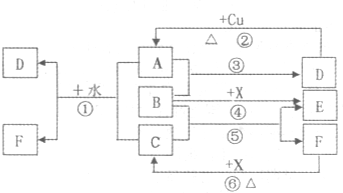
(1)F是气体,它能形成浓溶液,说明F极易溶于水,中学阶段只可能是氨气或氯化氢,又因为F的浓溶液能与黑色粉末X反应用于实验室制备单质气体C,实验室能用黑色粉末与溶液反应制备的气体只有氯气,结合氨水和盐酸的性质,可知:C是Cl2,F是HCl,X是MnO2.能与铜反应生成大气污染物的只有浓硫酸和硝酸,污染物只可能是SO2、NO2或NO,而能与氯气反应的只有SO2,则A是SO2,D是浓硫酸,SO2与Cl2、水反应会生成HCl和H2SO4,即D是H2SO4.因为SO2与B反应生成硫酸,硫元素化合价由+4升高到+6,则B必具有氧化性,且含H、O元素,有18个电子,所以B是H2O2,根据反应④可推知E是O2.
反应⑥、⑤、③的化学方程式分别为:MnO2+4HCl=MnCl2+Cl2↑+2H2O、Cl2+H2O2=O2↑+2HCl、SO2+H2O2=H2SO4.
根据氧化剂的氧化性比氧化产物的氧化性强可知,氧化性从强到弱的顺序是MnO2>Cl2>H2O2>H2SO4,
故答案为:MnO2>Cl2>H2O2>H2SO4;
(2)Cl原子核外有17个电子,根据电子排布规律可知,其电子排布式为1S22S22P63S23P5,根据氯气具有强氧化性,则它能够杀菌消毒,
故答案为:1S22S22P63S23P5;消毒;
(3)根据③可知,SO2与H2O2反应的化学方程式是SO2+H2O2=H2SO4,故答案为:SO2+H2O2=H2SO4;
(4)MnO2与H2O2和硫酸混合,MnO2溶解,产生气体,根据化合价变化,即锰元素降价,氧元素升价,可知化学方程式为H2SO4+H2O2+MnO2═MnSO4+O2↑+2H2O,
离子方程式为2H++H2O2+MnO2═Mn2++O2↑+2H2O,故答案为:2H++H2O2+MnO2═Mn2++O2↑+2H2O.
