问题
选择题
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH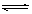 CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中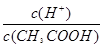 值增大。
值增大。
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O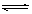 H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C.取c(H+)="0.01" mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
答案
答案:C
题目分析:
A、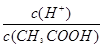 =
=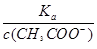 ,加入氢氧化钠溶液,c(CH3COO-)增大,
,加入氢氧化钠溶液,c(CH3COO-)增大,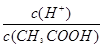 减小,错误;
减小,错误;
B、水中加入醋酸钠固体,CH3COO-与H+结合,水的电离平衡向右移动,错误;
C、同pH的盐酸和醋酸稀释相同的倍数后,醋酸中c(H+)大,与Zn反应速率快,正确;
D、硝酸钠溶液中加入盐酸,c(Na+)、c(NO3-)不变,c(Na+)=c(NO3-),错误。
