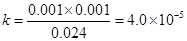问题
填空题
常温下,将0.05 mol·L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA。
(1)此一元弱酸的物质的量浓度为 ;
(2)此条件下该一元弱酸的电离平衡常数为 。
答案
(1)0.025 mol·L-1 (2)4.0×10-5
题目分析:(1)首先求出题出所给的氢氧化钠的物质的量浓度c(NaOH):设盐酸和氢氧化钠的体积分别为1L和2L,那么有如下关系: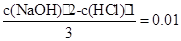 ,解之得:c(NaOH)="0.04" mol·L-1
,解之得:c(NaOH)="0.04" mol·L-1
用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,表明有如下关系:0.04 mol·L-1×12.5 mL=c(某酸) ×20 mL,解之得:c(某酸)= 0.025 mol·L-1
(2)一元弱酸HA溶液pH=3, HA = H+ + A-
起始: 0.025 0 0
转化: 0.001 0.001 0.001
平衡: 0.024 0.001 0.001
因此此条件下该一元弱酸的电离平衡常数为: