问题
选择题
25℃,加水稀释10mLpH=11的氨水,下列判断正确的是
A.原氨水的浓度=10-3mol /L
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中 的增大
的增大
D.再加入10mLpH=3的盐酸,混合液pH=7
答案
答案:C
题目分析:A、一水合氨是弱电解质,氨水中存在电离平衡NH3·H2O NH4++OH-。所以pH=11的氨水中c(OH-)=10-3mol/L,氢氧根离子浓度小于氨水浓度,所以氨水浓度大于10-3mol/L,故A错误;B、稀释氨水过程中,促进一水合氨电离,氢氧根离子、铵根离子、一水合氨浓度都减小,温度不变,水的离子积常数不变,氢离子浓度增大,故B错误;C、氨水稀释过程中,促进一水合氨电离,铵根离子个数增大,一水合氨分子个数减小,所以溶液中
NH4++OH-。所以pH=11的氨水中c(OH-)=10-3mol/L,氢氧根离子浓度小于氨水浓度,所以氨水浓度大于10-3mol/L,故A错误;B、稀释氨水过程中,促进一水合氨电离,氢氧根离子、铵根离子、一水合氨浓度都减小,温度不变,水的离子积常数不变,氢离子浓度增大,故B错误;C、氨水稀释过程中,促进一水合氨电离,铵根离子个数增大,一水合氨分子个数减小,所以溶液中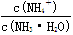 的增大,故C正确;D、常温下,pH=11的氨水和pH=3的盐酸等体积混合,由于盐酸的物质的量浓度小于氨水的,所以等体积混合时氨水的物质的量大于盐酸的物质的量,即氨水是过量的,所以混合溶液呈碱性,故D错误,答案选C。
的增大,故C正确;D、常温下,pH=11的氨水和pH=3的盐酸等体积混合,由于盐酸的物质的量浓度小于氨水的,所以等体积混合时氨水的物质的量大于盐酸的物质的量,即氨水是过量的,所以混合溶液呈碱性,故D错误,答案选C。
