草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。
(1)KHC2O4溶液呈__________性(填“酸”、“中”或“碱”)。
(2)下列化学方程式可能正确的是 。
A.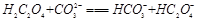
B.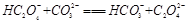
C.
D.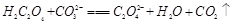 (3)常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加0.01 mol·L-1的KOH溶液V mL,回答下列问题:
(3)常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加0.01 mol·L-1的KOH溶液V mL,回答下列问题:
①当V<10时,反应的离子方程式为______________________________________________。
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH______7(填“>”“<”或“=”),V________10(填“>”“<”或“=”)。
③当溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为____________,V________10(填“>”、“<”或“=”)。
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为____________________________________________________________________________________。
(1)酸
(2)BD
(3)①H2C2O4+OH-=HC2O4-+H2O ②= > ③KHC2O4 =
④c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4)
题目分析:(1)KHC2O4溶液是强碱弱酸盐所以显碱性。
(2)由25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。数据可知酸性强弱H2C2O4> HC2O4-> H2CO3> HCO3-。所以BD正确。
(3)因为H2C2O4是弱酸,分步电离氢离子,与碱反应时,先生成HC2O4-,然后再生成C2O42-,所以当V<10时,反应的离子方程式为H2C2O4+OH-=HC2O4-+H2O。
②根据电荷守恒可知c(H+) +c(K+)=2c(C2O42-)+c(HC2O4-) +c(OH-)。若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则c(H+) =c(OH-)。 pH=7,V>10。
③当溶液中有c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),根据物料守恒可知溶液中只有一种溶质KHC2O4,此时V=10,若酸过量或者碱过量或者生成K2C2O4,则上式均不成立。
④当V=20时,,刚好反应生成K2C2O4,水解呈碱性。溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4)。
