问题
选择题
在25℃时,甲、乙两个烧杯中分别盛有1 L、pH均为2的盐酸和醋酸,现分别投入0.12 g镁粉充分反应,下列说法中,正确的是
A.反应过程中,两个烧杯中产生氢气的速率一直相等
B.反应结束后,两个烧杯中产生氢气的物质的量相等
C.反应结束后,乙烧杯中有镁粉剩余
D.反应结束后,甲烧杯中溶液呈中性
答案
答案:B
题目分析:盐酸是强酸,则pH=2的盐酸溶液的浓度是0.01mol/L,因此溶液中氢离子的物质的量是0.01mol。醋酸是弱酸,存在电离平衡CH3COOH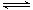 CH3COO-+H+,所以pH=2的醋酸溶液的浓度大于0.01mol/L。金属镁的物质的量是0.12g÷24g/mol=0.005mol,所以镁与盐酸反应时二者恰好反应,与醋酸反应时镁是不足的。A、醋酸是弱酸,在反应过程中不断电离出氢离子,因此反应过程中,两个烧杯中产生氢气的速率是醋酸的大于盐酸的,A不正确;B、反应结束后,两个烧杯中产生氢气的物质的量相等,都是0.005ml,B正确;C、反应结束后,甲烧杯中有镁粉剩余,C不正确;D、反应结束后,甲烧杯中生成的氯化镁水解,溶液显酸性,D不正确,答案选B。
CH3COO-+H+,所以pH=2的醋酸溶液的浓度大于0.01mol/L。金属镁的物质的量是0.12g÷24g/mol=0.005mol,所以镁与盐酸反应时二者恰好反应,与醋酸反应时镁是不足的。A、醋酸是弱酸,在反应过程中不断电离出氢离子,因此反应过程中,两个烧杯中产生氢气的速率是醋酸的大于盐酸的,A不正确;B、反应结束后,两个烧杯中产生氢气的物质的量相等,都是0.005ml,B正确;C、反应结束后,甲烧杯中有镁粉剩余,C不正确;D、反应结束后,甲烧杯中生成的氯化镁水解,溶液显酸性,D不正确,答案选B。
