问题
填空题
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- | 10% |
| B | 硫酸氢钠溶液: HSO4- H++SO42 H++SO42 | 29% |
| C | 醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D | 盐酸: HCl=H++Cl- | 100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
答案
(1)ADBC
(2) 硫酸第一步电离的
硫酸第一步电离的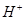 对第二步电离有抑制作用,
对第二步电离有抑制作用,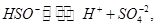 使平衡向左移动,即电离度小于硫酸氢钠溶液中
使平衡向左移动,即电离度小于硫酸氢钠溶液中 的电离度。
的电离度。
(3)
题目分析:(1)硫酸是二元酸;电离度越大,电离出的c(H+)越大;
(2)对于一个可逆反应来讲,增大生成物的浓度,平衡是逆向移动的。
(3)公式推导。
