问题
选择题
25℃时,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法正确的是
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都呈酸性
C.①②中分别加入少量CH3COONa固体,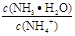 的值都变小
的值都变小
D.将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则:c(NH4+) >c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
答案
答案:D
题目分析:A、氨水是弱电解质,存在电离平衡,稀释100倍,pH值变化小于2,错误;B、等体积①③混合得到氯化铵,水解呈酸性;等体积②④混合得到氯化铵与氨水混合物,氨水电离为主,溶液为碱性,错误;C、加入的CH3COONa固体水解呈碱性,抑制氨水的电离,比值变大,错误;D、溶液为等浓度的氨水和氯化铵溶液混合,存在氨水的电离平衡和铵根离子的水解平衡,根据溶液为碱性,确定以氨水的电离平衡为主,则有c(NH4+) >c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+),正确。
