物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示): 、 、 。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO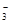 )>c(SO
)>c(SO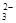 )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH (填“大于”、“小于”或“等于”)7,理由是 。
(1) H2O H++OH- ; HSO3-
H++OH- ; HSO3- H++SO32-; HSO3-+H2O
H++SO32-; HSO3-+H2O H2SO3+OH- ; 大于; 在NaHSO3溶液中存在HSO3-的电离(HSO3-
H2SO3+OH- ; 大于; 在NaHSO3溶液中存在HSO3-的电离(HSO3- H++SO32-)和水解(HSO3-+H2O
H++SO32-)和水解(HSO3-+H2O H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-) (回答出电离大于水解即可);
H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-) (回答出电离大于水解即可);
(2)大于或等于;若HA是强酸,pH=7,若HA是弱酸,pH>7。
题目分析:(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系有电离平衡:H2O H++OH- ; HSO3-
H++OH- ; HSO3- H++SO32-和水解平衡:HSO3-+H2O
H++SO32-和水解平衡:HSO3-+H2O H2SO3+OH-。由于在该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),说明HSO3-电离作用大于水解作用。因为在溶液中在NaHSO3溶液中存在HSO3-的电离(HSO3-
H2SO3+OH-。由于在该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),说明HSO3-电离作用大于水解作用。因为在溶液中在NaHSO3溶液中存在HSO3-的电离(HSO3- H++SO32-)和水解(HSO3-+H2O
H++SO32-)和水解(HSO3-+H2O H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-)。(2)若HA为强酸,则c(H+)=c(OH-).溶液显中性,pH=7;若HA为弱酸,则c(H+)<c(OH-).溶液显碱性,pH>7。
H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-)。(2)若HA为强酸,则c(H+)=c(OH-).溶液显中性,pH=7;若HA为弱酸,则c(H+)<c(OH-).溶液显碱性,pH>7。
