某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
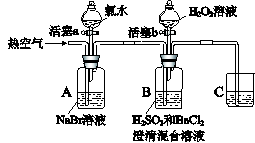
实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色。 |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是 。
(2)实验操作II吹入热空气的目的是 。
(3)装置C的作用是 ,C中盛放的药品是 。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 。
(5)由上述实验得出的结论是 。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
。
(16分,每空2分)
(1)2Br-+Cl2=Br2+2Cl-
(2)吹出单质Br2
(3)吸收尾气 NaOH溶液
(4)H2O2+2Br-+2H+=Br2+2H2O
(5)氧化性:H2O2>Br2>H2SO3
(6)
① 不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时无明显颜色变化,即能证明Br2氧化了H2SO3
② H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可)
题目分析:(1)氯水中的Cl2置换Br‾。
(2)利用Br2的挥发性,吹入热空气使Br2挥发。
(3)因为Cl2、Br2有毒,所以C中盛放NaOH溶液,除去尾气中的有毒气体,防止污染环境。
(4)混合液逐渐变成红棕色,说明H2O2把Br‾氧化为Br2,配平可得离子方程式。
(5)根据氧化剂的氧化性大于氧化产物,可知:H2O2>Br2>H2SO3。
(6)①溶液无明显颜色变化,说明Br2参加了反应,即氧化了H2SO3。
②实验操作III发生的反应为H2O2氧化Br‾,开始时颜色无明显变化,说明反应收到了影响,H2SO3有剩余、H2O2浓度小、Br-与H2O2反应慢等都是可能因素。
