食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: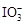 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I-;②KI+I2
>I-;②KI+I2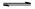 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有 (用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| 0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol·L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
表中数据:t1 t2(填“>”、“<”或“=”);表中V2=___________mL
(共14分)
(1)① Fe2+ , Fe 3[Fe(CN)6]2 (各1分)
②IO3-+5I-+6H+=3I2+3H2O 2Fe3++2I-=2Fe2++I2 (各2分)
(2)O2+4KI+2H2O=2I2+4KOH (2分)
KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华。(2分)
(3)< ; 40 (各2分)
题目分析:
(1)①Fe2+与铁氰化钾溶液有特征反应现象。
②应用信息:“氧化性:IO3->Fe3+>I2”,说明IO3-和Fe3+均能氧化I-生成I2。
(2)KI被潮湿空气氧化而引起损失,所以考虑I-被氧气氧化形成I2升华从而造成损失。
根据已知信息:“KI+I2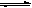 KI3”解析其性质不稳定性,易发生分解过程。
KI3”解析其性质不稳定性,易发生分解过程。
(3)由表格信息可知,三组实验为平行对照实验,要遵循“单一变量”的规则,因此这三组实验溶液的总体积都等于50 ml,因此V2="40" ml。实验1和实验2比较,实验2中水的体积多,说明溶质浓度比实验1中的要小,反应速率慢,所用时间长,所以t1<t2
考点定位:考查了离子的检验,氧化还原反应的书写,实验设计数据分析等相关知识,培养学生题干信息的读取和分析的能力。
