Ⅰ.卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性
质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
请回答:
(1)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(2)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
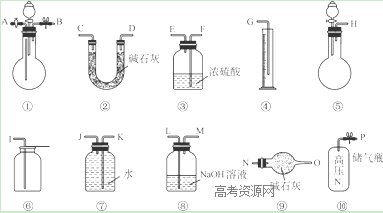
Ⅱ.过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序:
甲同学:⑤—⑧—③—⑦—④; 乙同学:⑤—③—②。
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。
(2)乙同学想通过实验测得的数据是________________。有人认为按他测得的数据计算出的实验结果可能偏高,原因是________________; 为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
Ⅰ(1) BrO3-> IO3-> Br2 > I2 (2分) BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O(2分)
(2) 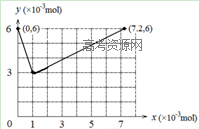 (2分)
(2分)
Ⅱ(1) 生成的氧气的体积 (1分) ③(1分)
(2) 生成的二氧化碳的质量 (1分)
空气中的水与二氧化碳进入②增重使结果偏大(1分) ⑩①③②⑨(2分)
题目分析:Ⅰ(1)在同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,所以由①得氧化性BrO3‾>I‾,由②得BrO3‾>IO3‾,由④得IO3‾>Br2,综合可得氧化性由强到弱的顺序为BrO3-> IO3-> Br2 > I2 ;KBrO3与KBr在酸性条件下生成Br2,进而得出离子方程式。
(2)反应前锥形瓶中含I‾,物质的量为0.03L×0.2mol•L‾1=6×10-3mol,图像的起点(0,6),根据方程式BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O,可得I‾完全反应需要BrO3‾:6×10-3mol÷6=10-3mol,生成I2的物质的量为:6×10-3mol÷2=3×10-3mol,得坐标(1,3),步骤ⅱ发生反应:2BrO3-+ I2 = 2IO3- + Br2,3×10-3mol的I2完全反应需要BrO3‾:3×10-3mol×2=6×10-3mol,生成的IO3‾为6×10-3mol, BrO3‾可氧化Br‾,BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O,10-3mol的Br‾需要BrO3-物质的量:0.2×10-3mol,得终点坐标(7.2,6),把各点连线可得图像。
Ⅱ(1)甲同学装置用了⑦—④,可以测量氧气的体积;因为后面用排水法测量氧气的体积,所以③用浓硫酸干燥没有必要。
(2)乙同学实验装置为⑤—③—②,碱石灰增加的质量为二氧化碳的质量,所以乙同学的目的为测量二氧化碳的质量;乙同学没有防止外界空气中的二氧化碳、水分进入的装置,会导致空气中的二氧化碳和水分进入②增重使结果偏大;通过储气瓶通入N2把装置内空气排出,最后连上盛有碱石灰的干燥管,防止外界空气中的二氧化碳和水进入,所以改进后的仪器顺序为:⑩①③②⑨。
