已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是
| 酸 | 电离平衡常数 |
| 醋酸 | K i=1.75×10-5 |
| 次氯酸 | K i=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
A.25℃,等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量最小的是Na2CO3
B.少量的SO2通入NaClO溶液中反应的离子方程式为:SO2 + H2O + 2ClO—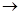 SO32— + 2HClO
SO32— + 2HClO
C.少量CO2通入Ca(ClO)2溶液中反应的离子方程式为:CO2 + H2O + ClO—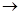 HCO3— + HClO
HCO3— + HClO
D.向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能
CD
题目分析:在相同温度下,酸的电离平衡常数越小,其相应的盐水解程度越大,溶液的碱性就越强,即pH越大。若盐溶液的pH相同,则电离平衡常数大的相应的盐浓度大,电离平衡常数小的相应的盐浓度小。A.电离平衡常数HCO3-< HSO3-<HClO<CH3COOH。所以等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量浓度最小的是Na2CO3。但是浓度小,物质的量不一定小。错误。B. SO2有还原性,NaClO有氧化性,二者发生氧化还原反应。反应方程式为:SO2 + H2O + ClO—=SO42— + 2H++Cl-。错误。C.少量CO2通入Ca(ClO)2溶液中,由于酸性H2CO3>HClO> HCO3-。根据强酸制取弱酸的性质。反应的离子方程式为: CO2 + H2O + ClO—= HCO3— + HClO。正确。D.若温度不变,向pH=a的醋酸溶液中加一定量水,若原来是稀溶液,稀释作用大于平衡正向移动是c(H+)增大的趋势,所得溶液的pH>a;若原来是浓溶液,加水时使酸分子的电离作用大于水的稀释作用,平衡正向移动是c(H+)增大的趋势,所得溶液的pH<a;若加水时使酸分子的电离作用等于加水对溶液的稀释作用,平衡不发生移动pH=a。故三种情况均有可能。正确。
