向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为________________________________,
从开始通入Cl2到n(Cl2)=0.12 mol时的总反应的化学方程式为______________________;
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
(1)I- Fe2+ I2
(2)Fe2+、Fe3+、Cl- 5FeI2+6Cl2=5I2+2FeCl3+3FeCl2
(3)8.96 L
(1)根据图像可知:首先I-被氧化,然后是Fe2+,所以还原性顺序为I->Fe2+>I2。(2)由图像可知n(I2)=0.1 mol,所以n(FeI2)=0.1 mol,n(I-)=0.2 mol。当通入0.12 mol Cl2即0.24 mol Cl时,I-全部被氧化,Fe2+有0.04 mol被氧化,所以溶液中的离子主要有:Fe2+、Fe3+、Cl-,其物质的量分别为0.06 mol、0.04 mol、0.24 mol,
I2为0.1 mol。
n(I2)∶n(FeCl3)∶n(FeCl2)=0.1∶0.04∶0.06=5∶2∶3
方程式为5FeI2+6Cl2=5I2+2FeCl3+3FeCl2。
(3)Fe2+ ~ 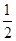 Cl2 I- ~
Cl2 I- ~ 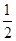 Cl2 I2~2IO3-~5Cl2
Cl2 I2~2IO3-~5Cl2
0.1 mol 0.05 mol 0.2 mol 0.1 mol x 2x 5x
由题意得:
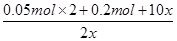 =8
=8
x=0.05 mol
V(Cl2)=(0.05 mol+0.1 mol+5×0.05 mol)×22.4 L·mol-1=8.96 L。
