问题
选择题
常温下,0.1 mol/L某一元酸(HA)溶液中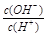 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
答案
答案:C
题目分析:0.1 mol/L某一元酸(HA)溶液中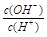 =1×10-8,而溶液中c(H+)·c(OH-)=10-14.解得c(OH-)=10-11.所以c(H+)10-3mol/L<c(HA),所以该酸是弱酸。A.所以溶液中水电离出的c(H+)=c(OH-)=10-11 mol/L。错误。B.根据物料守恒可得c(HA)+c(A-)=0.1 mol/L。错误。C.在弱酸的溶液中存在电离平衡HA
=1×10-8,而溶液中c(H+)·c(OH-)=10-14.解得c(OH-)=10-11.所以c(H+)10-3mol/L<c(HA),所以该酸是弱酸。A.所以溶液中水电离出的c(H+)=c(OH-)=10-11 mol/L。错误。B.根据物料守恒可得c(HA)+c(A-)=0.1 mol/L。错误。C.在弱酸的溶液中存在电离平衡HA A-+H+。溶液中加入一定量CH3COONa晶体,由于会发生反应CH3COO-+ H+=CH3COOH,会使c(H+)减小,所以根据水的离子积常数不变可知溶液的c(OH-)增大;若加水稀释,由于离子浓度减小的倍数多,所以平衡向电离的方向移动。由于稀释的倍数大于平衡移动增大的倍数。所以c(H+)减小。正确。D.若与0.05mol/LNaOH溶液等体积混合后,则得到的溶液为NaA与HA等浓度、等体积的混合溶液。由于酸的电离大于盐的水解,所以c(A-)>c(Na+)>c(H+)>c(OH-)。错误。
A-+H+。溶液中加入一定量CH3COONa晶体,由于会发生反应CH3COO-+ H+=CH3COOH,会使c(H+)减小,所以根据水的离子积常数不变可知溶液的c(OH-)增大;若加水稀释,由于离子浓度减小的倍数多,所以平衡向电离的方向移动。由于稀释的倍数大于平衡移动增大的倍数。所以c(H+)减小。正确。D.若与0.05mol/LNaOH溶液等体积混合后,则得到的溶液为NaA与HA等浓度、等体积的混合溶液。由于酸的电离大于盐的水解,所以c(A-)>c(Na+)>c(H+)>c(OH-)。错误。
