某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有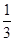 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(2)①Br2 ②Fe3+
(3)d 溶液呈血红色 b CCl4层呈无色
(4)①2Fe2++Br2=2Fe3++2Br- ②1.2 mol·L-1
(2)①若氧化性Fe3+>Br2,则Br2不能氧化Fe2+,故溶液呈黄色是加入的Br2的颜色。②若氧化性Br2>Fe3+,则Br2能将Fe2+氧化成Fe3+,故溶液呈黄色是因为生成的Fe3+显黄色。(4)②氧化性Br2>Fe3+,则还原性Fe2+>Br-,Cl2通入FeBr2溶液中先与Fe2+反应,若Cl2还有剩余再与Br-发生反应。现有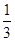 的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+
的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+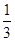 n(Br-)=0.20 mol,又因为n(Br-)=2n(Fe2+),则n(FeBr2)=0.12 mol,c(FeBr2)=1.2 mol·L-1。
n(Br-)=0.20 mol,又因为n(Br-)=2n(Fe2+),则n(FeBr2)=0.12 mol,c(FeBr2)=1.2 mol·L-1。
