问题
选择题
下列图示与对应的叙述相符的是
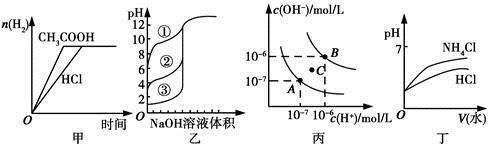
A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化
B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强
C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化
答案
答案:B
由于醋酸是弱酸,与盐酸等浓度时,盐酸中c(H+)大,反应速率快,A错;三种酸的浓度相等,根据开始滴定时的pH可知③酸性最强,B正确;因A点的Kw小于C点的Kw,故两点温度不同,C错;稀释时NH4+的水解程度增大,pH变化小于HCl,D错。
