问题
选择题
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
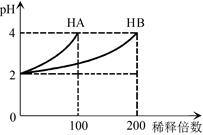
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
答案
答案:B
题目分析:pH=2的两种二元酸HA与HB各1mL,分别加水稀释,由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,则A、HB的电离方程式为HB H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
