问题
选择题
已知下列弱酸的电离常数:
H2CO3: Ka1=4.30×10-7 ;Ka2=5.61×10-11
H2SO3: Ka1=1.54×10-2;Ka2=1.02×10-7
HClO:Ka=2.95×10-8
下列离子在溶液中结合H+的能力不正确的是
A.HCO >HSO3-
>HSO3-
B.CO >SO
>SO
C.HCO >ClO-
>ClO-
D.ClO->SO
答案
答案:C
题目分析:根据弱酸的电离常数判断,酸性越强,其酸根离子结合H+的能力越弱。A、酸性:H2SO3> H2CO3,所以结合H+的能力HCO >HSO3-,正确;B、根据H2CO3:Ka2=5.61×10-11 H2SO3: Ka2=1.02×10-7判断酸性:HSO3-> HCO
>HSO3-,正确;B、根据H2CO3:Ka2=5.61×10-11 H2SO3: Ka2=1.02×10-7判断酸性:HSO3-> HCO ,所以结合H+的能力CO
,所以结合H+的能力CO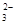 >SO
>SO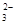 ,正确;C、酸性:H2CO3>HClO,所以结合H+的能力ClO-> HCO
,正确;C、酸性:H2CO3>HClO,所以结合H+的能力ClO-> HCO ,错误;D、酸性:HSO3->HClO,所以结合H+的能力ClO->SO
,错误;D、酸性:HSO3->HClO,所以结合H+的能力ClO->SO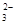 ,正确,答案选C。
,正确,答案选C。
