北京正负电子对撞机的核心部分是使电子加速的环形室,若一电子在环形室中沿半径为R的圆周运动,转了3圈回到原位置,则位移和路程分别是
A.0,2πR
B.0,6πR
C.2 R,2 R
D.2πR,2 R
答案:B
考点:
专题:直线运动规律专题.
分析:路程是标量,大小等于运动轨迹的长度.位移是矢量,大小等于初末位置间的距离,与运动路线无关.
解答:解:位移是矢量,大小等于初末位置间的距离.转了3圈回到原位置,故位移为零,最大路程等于转3圈轨迹的长度,即s=3×2πR=6πR.故B正确,A、C、D错误.
故选B.
点评:解决本题的关键知道路程是标量,大小等于运动轨迹的长度.位移是矢量,大小等于初末位置间的距离,与运动路线无关.

 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题 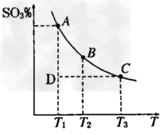
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”) 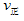 _____
_____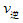 (填“>”“<”或“=”)
(填“>”“<”或“=”)