(16分)NH3在生活生产中用途广泛。
(1)下列关于NH3或氨水的实验能达到目的的是 (填编号)
| 编号 | A | B | C | D |
| 实验 装置 | 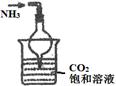 | 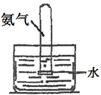 | 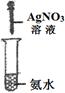 | 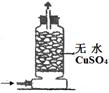 |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |
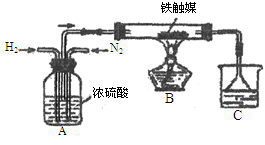
①N2和H2通过A装置,A装置的作用除了将气体混合外,还有 、 作用。
②实验结束,C中溶液有刺激性气味,C溶液中存在的含氮元素的微粒有 。
③某小组消耗大量的N2和H2,但得到的氨水浓度远低于其他组,可能的原因有 。(至少写出一项。注:实验试剂均未变质。)
(3)为验证氨水具有弱碱性,设计了下列实验,其中能达到实验目的是 。(填编号)
A.在氨水中滴入酚酞,溶液变红色
B.测定相同浓度的NaOH和氨水溶液的pH
C.将氨水和过量AlCl3溶液混合,产生白色沉淀
D.用pH试纸测定1mol/L NH4Cl溶液的酸碱性
(4)在实验室初步测定NH3•H2O的电离平衡常数。
①NH3•H2O电离平衡常数的表达式为:K= 。
②限选试剂和仪器:浓度为0.1mol/L 的氨水、0.1000mol/L 盐酸、1.000mol/L 盐酸、酚酞试剂、甲基橙试剂、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、pH计、烧杯等(省略夹持仪器)
| 实验步骤 | 实验目的 |
| 步骤1: ①用碱式滴定管取20.00ml 0.1mol/L 的氨水于锥形瓶中,加入几滴 。 ② 。 ③ ,停止滴定,记录数据。重复测定2-3次。 | 测定氨水的准确浓度。 |
| 步骤2: ; | ; |
| 步骤3:通过计算得出氨水的电离常数。 | |
(1)B (2分)
(2)①观测气体流速、干燥气体 (2分)
②NH4+ NH3·H2O NH3 (2分)
③氢气与氮气的流速过快而来不及反应、温度过高或过低条件,催化剂的催化效果不理想、所全的接触面过小 (2分)
(3)BD (2分)
(4)①K=c(NH4+)· c(OH-)/c(NH3·H2O) (2分)
步骤1:
①甲基橙试液。②用酸式滴定管取0.1000mol/L 盐酸,并进行滴定。(1分)
③当锥形中的溶液由黄色变为橙色,且保持半分钟不褪色,停止滴定,记录数据,重复2-3次 (1分)
步骤2:用PH计测出氨水的PH值 (1分)
通过测出的PH值计算得出c(OH-) (1分)
题目分析:(1)A.侯氏制碱法中,因为二氧化碳的溶解度小,氨气的溶解度大,应先通能入氨气,再通入过量的二氧化碳才能生成较多的碳酸氢铵
C.制备银氨溶液,应是在硝酸银溶液中滴加稀氨水,至产生的沉淀恰好溶解为止
D.无水硫酸铜用于检验水的存在而不用于干燥
(2)①从“浓硫酸”去理解和气泡的快慢观测气体的流速
②由NH3 + H2O ≒NH3·H2O NH3·H2O ≒ NH4+ + OH-可知
③主要从气的流速、催化剂的催化效果、反应的接触面等角度去答题
(3)抓住弱电解质的部分电离或相应的盐溶液的酸碱性
(4)①电离平衡常数的测定关键在于测出PH值计算出c(OH-),通过滴定法测定c(NH3·H2O)。

