问题
填空题
(5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
| 酸 | c(一元酸) /mol·L–1 | c(NaOH) /mol·L–1 | 混合溶液的pH |
| HX | 0.1 | 0.1 | pH = x |
| HY | 0.1 | 0.1 | pH = 7 |
| HZ | 0.1 | 0.1 | pH = 9 |
(2)HZ和NaOH发生反应的离子方程式为 ,所得溶液中pH大于7的原因是 (用化学方 程式表示)。
(3)HX反应后所得溶液中,由水电离产生的c(OH-)= mol·L-1,下列叙述是对x 值的判断,其 中正确的是 。
A.一定=7 B.可能<7 C. 一定≧7 D.一定>7
答案
(5分)(1)HY
(2)HZ +OH- ="=" H2O + Z-, H2O + Z-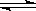 HZ+OH-
HZ+OH-
(3)10x-14 C
题目分析:(1)等物质的量的酸与氢氧化钠混合,溶液的酸碱性取决于酸的强弱,若酸是强酸,则溶液呈中性,若酸是弱酸,则溶液呈碱性,所以上述三种酸中一定属于强酸的是HY;
(2)从HZ与氢氧化钠混合液的pH判断HZ是弱酸,酸性离子方程式时不能拆成离子形式,所以离子方程式为HZ +OH- ="=" H2O + Z-,所得溶液中pH大于7的原因是因为Z-水解使溶液呈碱性,水解的离子方程式为H2O + Z-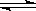 HZ+OH-
HZ+OH-
(3)HX与氢氧化钠溶液反应后的溶液的pH=x,则溶液中的c(H+)=10-xmol/L,溶液中的c(OH-)=10x-14 mol/L,HX若为强酸该溶液为中性溶液,若为弱酸,则该溶液为碱性溶液,所以溶液中的OH-的浓度即是水电离产生的OH-的浓度,c(OH-)=10x-14 mol/L;根据以上分析,x≧7,答案选C。
