背景材料:
阅读下 * * 段材料,根据要求完成任务。
材料一《普通高中化学课程标准(实验)》关于离子反应的内容标准是:通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。
材料二某版高中教科书化学《必修1》"离子反应"的部分内容
由于电解质溶于水后成为离子,所以,电解质在溶液中的反应必然有离子参加,这样的反应称作离子反应。
实际上,CuSO4溶液与稀NaCl溶液并没有发生化学反应,只是CuSO4电离出来的Cu2+、SO42+与NaCl电离出来的Na+、Cl-的混合。而CuSO4溶液与BaCl2溶液则发生了化学反应,生成了BaSO4白色沉淀。
CuSO4+BaCl2>=CuCl2>+BaSO4 我们来分析以下这个反应:
CUSO4和BaCl2发生了电离,其电离方程式如下:
CuSO4=2++SO42+
BaCl2=Ba2+2Cl-
当CuSO4溶液与BaCl2溶液混合时,Cu2+Cl之间没有发生化学反应;而SO42-和Ba2+之间发生了化学反应,生成难溶的BaSO4白色沉淀。所以,CuSO4溶液与BaCl2溶液反应的实质是:
Ba2++SO42-=BaSO4↓
像这种用实际参加的离子符号来表示反应的式子叫做离子方程式。
材料三教学对象为高中一年级学生,本节内容是初中学习溶液导电性实验、酸碱盐电离知识的延续和深化,又是学习电解质溶液理论知识的基础,起承上启下的作用。
问题:
(1)材料二中"实验1"和"实验2"的现象分别是什么?
(2)完成"离子反应"的教学设计,内容包括教学目标,教学重点、难点,教学过程。
参考答案:
(1)实验1无明显现象,实验2有白色沉淀出现。
(2)教学设计:
【教学目标】
知识与技能:理解离子反应的概念和原理:了解电解质在溶液里所起离子反应的本质;理解离子反应发生的条件;学会一般离子反应方程式的书写。
过程与方法:探究离子反应及其发生的条件;在学习离子反应过程中,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工;学习离子方程式的书写方法。
情感·态度·价值观:发展学习化学的兴趣,乐于探究离子反应及其发生的条件,体验科学探究的艰辛和喜悦,感受化学世界的奇妙与和谐。
【教学重点】离子反应及其发生的条件,离子方程式的书写。
【教学难点】离子反应方程式的书写。
【教学过程】
【导入新课】
复习:电解质和电离的概念。过渡:有上述知识作基础,下面我们学习离子反应和离子方程式。电解质在溶液里的反应必定有离子的参加,离子间是如何进行反应的呢?反应的本质是什么呢?
【推进新课】
师:请同学们阅读课本第30~31页的内容,进行自学。
【学生分组实验】做实验。通过操作实验仪器、观察实验现象,培养直觉行动思维。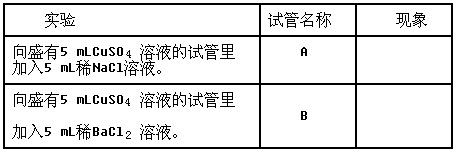
生:观察A、B试管中的现象。
师:观察到的现象是什么?
生:B试管中有白色沉淀生成,A试管溶液无现象。
师:完成上述反应的化学方程式。
【投影】用计算机做成三维动画片,演示给学生看。实验中看得见的白色沉淀和看不见的溶液中没有参加反应的离子,都可以用看得见的各种圆球表示,从而将直觉行动思维转化成具体形象思维。可加深对离子反应的认识和对离子反应本质的理解。
NaCl+CuSO4(不反应)
CuSO4+BaCl3=BaSO4↓(白)+CuCl2
师:从溶液中离子变化的角度,分析上述实验现象。
当CuSO4溶液与NaCl溶液混合时,没有发生化学反应,只是CuSO4电离出来的Cu2+、SO42-与Na+、Cl-等混合没有发生变化。当CuSO4溶液与BaCl溶液混合时,CuSO4电离出来的SO42-与BaCl电离出来的Ba2+反应生成难溶的BaSO4白色沉淀。
过渡:电解质在水作用下可解离成自由移动的阴、阳离子,这些电解质在溶液中发生的反应实质上是离子间的反应。
