问题
填空题
(1)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol
CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)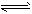 CH3OH(g)+H2O(g) △H=-49.0kJ/mol 测得CO2和
CH3OH(g)+H2O(g) △H=-49.0kJ/mol 测得CO2和
CH3OH(g)的浓度随时间变化如图。请回答
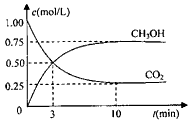
① 从反应开始到平衡,氢气的平均反应速率:v(H2)=________mol/(L·min)。
②升高温度,该反应的平衡常数的数值将________(填“增大”、“减小”或“不变”)。
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是________
A.加入催化剂
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入3molH2
(2)合成氨的热化学方程式为:N2(g)+3H2(g)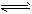 2NH3(g) △H=-92 kJ·mol-1。
2NH3(g) △H=-92 kJ·mol-1。
①某温度下,若把10mol N2与30mol H2置于体积为10L的密闭合成塔内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为1/5,则该温度下反应的K=___________(可用分数表示)。
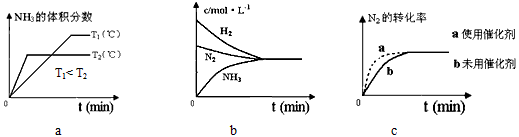
②对于合成氨反应而言,下列有关图象一定正确的是(填序号)_______________
答案
(1)①0.225;②减小;③CD
(2)①1/12 L2·mol-2(或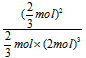 );②ac
);②ac
