(14分)工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是____________________。
(2)已知2SO2 (g)+ O2 (g) 2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L容积固定不变的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=____________。
②在①的条件下,判断该反应达到平衡状态的标志是_______(填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2
B.容器内气体的压强不变
C.容器内混合气体的密度保持不变
D.SO3的物质的量不再变化E.SO2的生成速率和SO3的生成速率相等
③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,则平衡后二氧化硫的转化率 氧气的转化率(填大于、小于或等于)。
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
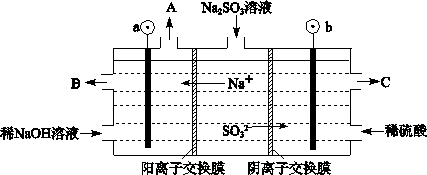
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为_______g(假设该过程中所有液体进出口密闭)。
(1)2SO2+2H2O+O2=2H2SO4 (2)①0.05mol/(L·min) ② BDE ③大于
(3)①负 硫酸 ② SO32-–2e-+H2O=SO42-+2H+ ③4.4
题目分析:(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是2SO2+2H2O+O2=2H2SO4 ;(2)①在反应开始时n(SO2) =2mol,5 min后反应达到平衡,二氧化硫的转化率为50%,则反应消耗的SO2的物质的量为1mol,因为在反应时SO2与 O2是按照2:1消耗的,所以反应的氧气的物质的量为0.5mol,因此υ(O2)=0.5mol÷2L÷5 min=0.05mol/(L·min);②A.在反应中SO2、O2、SO3是按照2:1:2的关系变化的,但是达到平衡时它们的关系可能符合上述比例,也可能不符合。因此不能作为平衡的标志。错误。B.由于该反应的反应前后气体体积不等,若达到平衡,则各种气体的物质的量不变,压强也不变。因此容器内气体的压强不变可以作为判断平衡的标志。正确。C.由于容器的容积不变,反应又符合质量守恒定律,所以无论反应进行到什么程度,容器内混合气体的密度都保持不变,故不可作为判断平衡的标志。错误。D.若反应达到平衡,任何一种物质的物质的量都不变,浓度也不变,因此SO3的物质的量不再变化可以作为判断平衡的标志。正确。E.每产生1个SO2就会同时消耗1个SO3。现在的SO2生成速率和SO3的生成速率相等,即SO2生成速率和SO2的生成速率相等,反应达到平衡。因此可作为判断平衡的标志 。正确。③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,n(SO2):n(O2)<2:1,氧气相对来说过量,所以平衡后二氧化硫的转化率大于氧气的转化率。(3)①在图中由于Na+向a极区域移动,根据同种电荷相互排斥,异种电荷相互吸引的原则a要连接电源的负极,b连接电源的正极,在阳极上SO32-不断放电变为SO42-,因此从C口流出的物质是硫酸。②SO32-放电的电极反应式为SO32-–2e-+H2O=SO42-+2H+。③电解过程中若消耗12.6gNa2SO3,n(Na2SO3)= 12.6g÷126g/mol=0.1mol,则电子转移0.2mol,在阴极发生反应:2H++2e-=H2↑.放出氢气0.1mol,质量减轻0.2g,同时移向该区域0.2mold Na+,是溶液增重4.6g,故该区域的质量总增重4.4g。
