问题
填空题
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C(s)+H2O(g) CO(g)+H2(g) △H= +131.3kJ·mol-1
CO(g)+H2(g) △H= +131.3kJ·mol-1
(1)上述反应达到平衡后,将体系中的C(s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
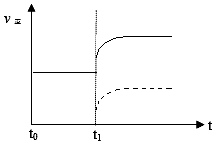
(2)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(3)已知平衡时T相同,c(CO)×c(H2)÷c(H2O)的值相等。一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

(4)己知:
2C(s) + O2(g) = 2CO(g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2(g) △H = -566.0 kJ·mo1-1
2H2(g) + O2(g) = 2H2O(g) △H = -483.6 kJ·mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为_____________kJ。
答案
(1)向左移
(2)
(3)0.60;>
(4)-787.0
