工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|
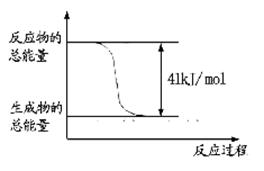
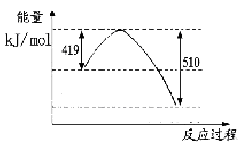 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。该反应的△S____0(填“>”或“<”或“=”),在 ______情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是 __ (选填编号)。
A.3v正(H2)=v逆(CO2) B.C(H2) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
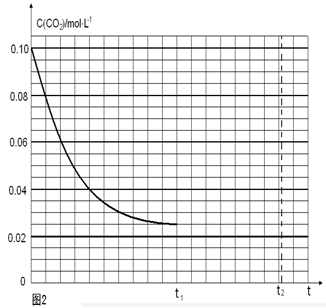
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示。保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(1)3H2(g) + CO2(g)= CH3OH(l)+ H2O(l);ΔH=-50KJ/mol;<; 低温;(2)A、D;
(3)CD;(4)0.01mol.L-1.min-1;画图
题目分析:(1)根据题意可得热化学方程式:①CO(g)+H2O(l)=CO2(g)+H2(g) ΔH=-41KJ/mol; ②CO(g) +H2(g) =CH3OH(l)ΔH=-91KJ/mol; ②-①,整理可得3H2(g) + CO2(g)= CH3OH(l)+ H2O(l);ΔH=-50KJ/mol;由方程式可知,该反应是一个体系的混乱程度减小的反应。所以△S<0;由于该反应的正反应是放热反应,所以反应在低温情况下有利于该反应自发进行。(2)由于该反应的正反应是放热反应,所以上述反应方程式的平衡常数K值变大,则平衡正向移动。由于K只与温度有关,而与压强、浓度等无关,所以只有温度降低才可以满足条件。当降温时,V正、V逆都减小,V逆减小的多,V正>V逆,平衡正向移动,逆反应速率先减小后又略有增加。因此选项为A、D。(3)A.若反应达到平衡,则v正(H2)= 3v逆(CO2)。错误。B.由于二者消耗时是按照3:1的物质的量的关系消耗的,所以在开始加入的这两种气体只有按照某一确定的比例混合,达到平衡时才有关系:C(H2) = C(CO2)。因此不能作为判断平衡的标志。错误。C.由于生成物有液态物质,若反应未达到平衡,则气体的质量就会发生变化,气体的密度也会发生改变。因此容器内气体的密度不变,可以作为判断平衡的标志。正确。D.该反应是反应前后气体体积不等的反应,如果未达到平衡,则气体的物质的量就会发生变化,则容器内气体的压强就会改变。因此容器内压强不变可以作为判断平衡的标志。正确。(4)反应的容器容积为2.0L,容器内气体的密度增大了2.0g/L,则气体的质量增加了2.0g/L×2.0L=4.0g.其中增加的CO2的质量为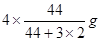 ;所以Δn(CO2)=" Δm÷M="
;所以Δn(CO2)=" Δm÷M=" 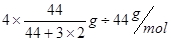 =0.08mol,因此V(CO2)= Δc(CO2)÷Δt="(0.08mol" ÷2L)÷4min = 0.01mol/(L·min)。
=0.08mol,因此V(CO2)= Δc(CO2)÷Δt="(0.08mol" ÷2L)÷4min = 0.01mol/(L·min)。
由图像可知:反应CO2(g)+3H2(g) CH3OH(l)+H2O(l)中起始时c(CO2)=0.10mol/L,平衡时c(CO2)=0.025mol/L,则Δc(CO2)=0.075mol/L,所以平衡时各物质的浓度为:c(H2)=0.075mol/L,该反应的平衡常数
CH3OH(l)+H2O(l)中起始时c(CO2)=0.10mol/L,平衡时c(CO2)=0.025mol/L,则Δc(CO2)=0.075mol/L,所以平衡时各物质的浓度为:c(H2)=0.075mol/L,该反应的平衡常数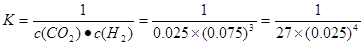 ;当保持其他条件不变,t1时将容器体积压缩到1L,c(CO2)=0.05mol/L,c(H2)=0.15mol/L,平衡向右移动,设消耗c(CO2)=xmol/L,则消耗c(H2)=3xmol/L,平衡时各物质的浓度分别为c(CO2)="(0.05-x)mol/L" ,c(H2)="(0.15-3x)mol/L" ,平衡常数不变。即
;当保持其他条件不变,t1时将容器体积压缩到1L,c(CO2)=0.05mol/L,c(H2)=0.15mol/L,平衡向右移动,设消耗c(CO2)=xmol/L,则消耗c(H2)=3xmol/L,平衡时各物质的浓度分别为c(CO2)="(0.05-x)mol/L" ,c(H2)="(0.15-3x)mol/L" ,平衡常数不变。即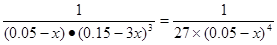 ,解得x= 0.025mol/L,则t2达到新的平衡时c(CO2)=0.025mol/L.故t1后c(CO2)随时间t变化趋势曲线为如图所示。
,解得x= 0.025mol/L,则t2达到新的平衡时c(CO2)=0.025mol/L.故t1后c(CO2)随时间t变化趋势曲线为如图所示。
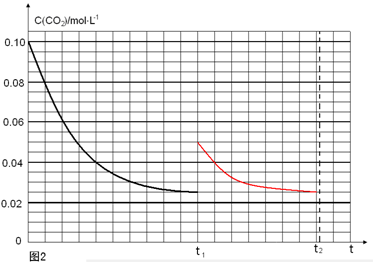 2浓度与时间图像的表示。
2浓度与时间图像的表示。

