问题
选择题
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
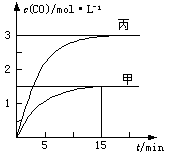
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
答案
AB
题目分析:A项根据图中甲容器中CO的平衡浓度可得在前15 min的平均速率v(H2)=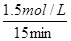 =0.1 mol·L-1·min-1,正确;B项当丙容器的体积V=0.5 L,根据等效平衡原理CO的平衡浓度应小于3.0mol/L,只有体积缩小才能使CO的平衡浓度达到3.0mol/L,正确;C项据甲容器的平衡浓度计算平衡常数K=
=0.1 mol·L-1·min-1,正确;B项当丙容器的体积V=0.5 L,根据等效平衡原理CO的平衡浓度应小于3.0mol/L,只有体积缩小才能使CO的平衡浓度达到3.0mol/L,正确;C项据甲容器的平衡浓度计算平衡常数K=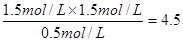 ,错误;D项由于固体物质不影响平衡,则甲、乙两容器若在同温能达到全等平衡,即n(H2O)=0.5mol>0.4mol,再结合正反应吸热,说明乙容器的温度低(T1>T2),错误。
,错误;D项由于固体物质不影响平衡,则甲、乙两容器若在同温能达到全等平衡,即n(H2O)=0.5mol>0.4mol,再结合正反应吸热,说明乙容器的温度低(T1>T2),错误。