(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E H=+a kJ/mol;
② 2A→A-A H=-b kJ/mol;
③ E+A→A-E H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 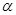 1 1 | 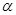 2 2 | 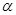 3 3 |
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
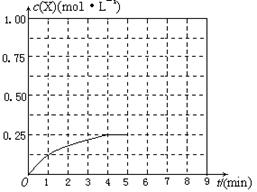
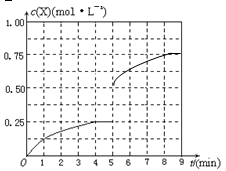
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
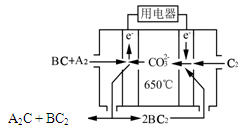
⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
⑴离子键、极性键(或共价键)
⑵ H2(g)+Cl2(g)=2HCl(g) H=(a+b-2c)kJ·mol-1[H表示成-(2c-a-b)kJ·mol-1也可]
⑶①0.125 mol·L-1·min-1
②4 L2/mol2 ③ ABD
④
⑷ O2+4e-+2CO2=2CO32-
题目分析:根据题意依次推出A为氢元素,B为碳元素,C为氧元素,D为钠元素,E为氯元素;
⑴A、C、D形成的化合物为NaOH,其所含化学键为离子键、极性键(或共价键);
⑵首先写出A2与E2反应的方程式,并标出各物质的状态为H2(g)+Cl2(g)=2HCl(g);将“①-②+③×2”得该化学方程式,根据盖斯定律得该反应热H=(a+b-2c)kJ·mol-1,据此便可写出完整的热化学方程式;
⑶①A2的平均反应速率v (A2)=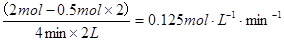 ;
;
②该温度下此反应的平衡常数K= ;
;
③甲和乙两容器的平衡状态为全等平衡,则有α1+α2=1,Q1+Q2=Q,P1=P2,n2=n1=0.5 mol;由于丙容器的起始量是甲的2倍,可将丙容器的体积扩大2倍(与甲同压等效),然后再恢复到原体积,则可得α3>α1,P3<2P1,n2<1.0 mol<n3,Q3>2Q1,综上只有A、B、D项正确。
④第5min时X的物质的量浓度变为0.5 mol/L(体积变为1 L),再根据“第8min达到新的平衡时A2的总转化率为75%”,则到新平衡时X的物质的量浓度为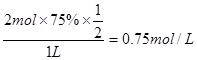 ,据此便可作图。
,据此便可作图。
⑷O2在正极上发生还原反应生成CO32-:O2+4e-+2CO2=2CO32-。
