问题
计算题
标准状况下1.68L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原子气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
答案
(1)m(CO2)=15.0g×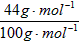 =6.6g
=6.6g
m(CO2+H2O)=9.3g
m(H2O)=9.3g-6.6g=2.7g
(2)n(CO2)=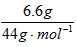 =0.15mol
=0.15mol
n(H2O)= =0.15mol
=0.15mol
分子中C∶H=1∶2 n(无色可燃气体)=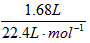 =
=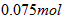
分子中C原子数=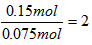 ,
,
分子中氢原子数=2×2=4 所以该气体的分子式是C2H4
(3)C4H6和H2(或C3H8和CO,C3H6和CH2O等)
