(5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
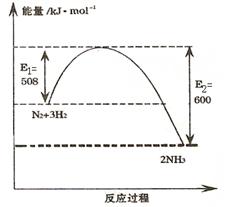
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 | |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 | |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
(5分)(1)N2(g)+3H2(g)====2NH3(g) △H="-92" kJ·mol–1 (无条件不扣分)
(2)① 0.05 ② 27.6kJ ③ 0.15 ④正反应
题目分析:(1)由图可知,反应物的总能量高于生成物的总能量,该反应是放热反应,△H="508-600=-92" kJ·mol–1 ,所以该反应的热化学方程式为N2(g)+3H2(g)====2NH3(g) △H="-92" kJ·mol–1 ;
(2)①0~1h内,氢气的浓度减少(4.5-4.2)mol/2.00L=0.15mol/L,所以氮气的浓度减少0.05mol/L,则0~1h内N2的平均反应速率为0.05 mol/(L·h);
②反应进行到2h时,消耗氮气0.3mol,所以放出的热量是0.3mol×92 kJ·mol–1=27.6kJ;
③反应进行到3h时达平衡状态,此时c(NH3)=0.5mol/L,c(N2)= 0.5mol/L,c(H2)="1.5" mol/L,所以化学平衡常数K= c2(NH3)/ c(N2)·c3(H2)=0.15;
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,此时c(NH3)=1.0mol/L,c(N2)= 1.0mol/L,c(H2)="2.0" mol/L,c2(NH3)/ c(N2)·c3(H2)=0.125<K,所以平衡向正反应方向移动。

