已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol
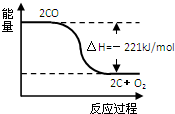
B.右图可表示①的反应过程和能量关系
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
A、该反应没有生成稳定氧化物,因此碳的燃烧热比此处反应热的绝对值大,故A正确;
B、①的反应过程C和O2是反应物,CO是生成物,放出热量,而右图可表示CO是反应物,C和O2是生成物,放出热量,故B错误;
C、已知中和热为放热反应,则叙述中和热时不用“-”,即稀硫酸与稀NaOH溶液反应的中和热为57.3kJ•mol-1,故C正确;
D.醋酸为弱电解质,电离过程为吸热过程,则稀醋酸与稀NaOH溶液反应生成lmol水,放出的热量小于57.3kJ,故D错误.
故选AC.
