已知2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452kJ/mol
根据以上热化学方程式,下列判断正确的是( )
A.CO的燃烧热为283 kJ
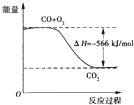
B.如图可表示CO生成CO2,的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol
D.2 mol CO2(g)与2 mol Na2O2(s)反应放出452 kJ热量时,电子转移数约为1.204×1024
A、2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量,则一氧化碳的燃烧热为283KJ/mol,故A错误;
B、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,分析图象中一氧化碳和氧气物质的量为1、
,物质的量不符合反应物质的物质的量,故B错误;1 2
C、2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452,但是△H>-452 kJ/mol,即2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol,故C错误;
D、由2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452kJ/mol,可知2 mol CO2(g)与2 mol Na2O2(s)反应放出452 kJ热量时,消耗2molNa2O2,1个Na2O2发生反应转移的电子数为1个,所以2molNa2O2反应转移电子数是2×6.02×1023=1.204×1024,故D正确;
故选D.

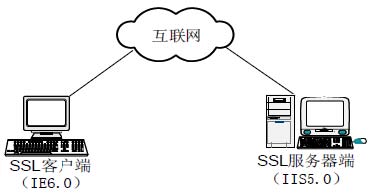 图 3-1
图 3-1 图 3-2
图 3-2