问题
选择题
对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
A.Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B.反应过程中能量关系可用如图表示
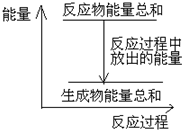
C.若将该反应设计成原电池,则Zn为负极
D.若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体
答案
A、Zn和H2SO4的反应是放热反应,所以Zn和H2SO4的总能量大于ZnSO4和H2的总能量,故A正确;
B、因放热反应中反应物的总能量大于生成物的总能量,可用如图表示

,故B正确;
C、因Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的反应中锌失去电子,化合价升高,作原电池的负极,故C正确;
D、根据总反应:Zn+H2SO4 =ZnSO4 +H2
65g 22.4L
65g 22.4L
所以65g锌溶解时,正极放出22.4L气体,故D错误;
故选:D.
