红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式______;
(2)PCl5分解生成PCl3和Cl2的热化学方程式______;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2______α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=______;P和Cl2一步反应生成1mol PCl5的△H4______△H3(填“大于”、“小于”或“等于”),原因是______.
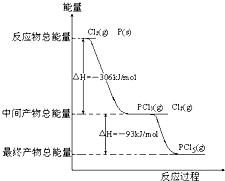
(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,热化学方程式为P(s)+
Cl2(g)═PCl3(g);△H=-306 kJ/mol,3 2
即2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol,故答案为:2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol;
(2)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式为PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,PCl5分解率α1=
×100%=25%.PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,0.8-0.6 0.8
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;25%;大于;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成;
(4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
2P(s)+3Cl2(g)=PCl3(g);△H1=-612 kJ/mol,
Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,根据盖斯定律:化学反应不管是一步完成,还是分步完成,化学反应的焓变是一样的,
故答案为:-399kJ/mol;等于;根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的.

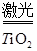 2H2↑+O2↑,下列说法错误的是
2H2↑+O2↑,下列说法错误的是