问题
选择题
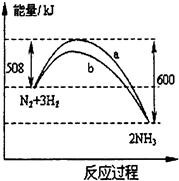
一个化学反应一般都有旧化学键的破坏和新化学键的形成.在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催
化剂的反应历程),下列叙述正确的是
①使用催化剂可降低生产能耗
②该反应的热化学方程式为N2(g)+3H2(g)

2NH3(g)+92kJ
③相同状况下,lmol氮气和3mol氢气总能量高于2mol氨气的总能量
4相同状况下,lmol氮气和3mol氢气总键能低于2mol氨气的总键能( )
A.①②③④
B.只有②③④
C.只有①②③
D.只有②③
答案
①催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降低生产能耗,故正确.
②该反应放出的能量大于吸收的能量,所以放热,故该热化学方程式正确.
③该反应放热,所以反应物的总能量大于生成物总能量,所以相同状况下,lmol氮气和3mol氢气总能量高于2mol氨气的总能量,故正确.
④该反应放热,反应热=反应物的键能-生成物的键能,所以相同状况下,lmol氮气和3mol氢气总键能低于2mol氨气的总键能,故正确.
故选A.
