以黄铁矿为原料生产硫酸的主要设备是沸腾炉、(炉气精制)、接触室和吸收塔等.
(1)请写出炉气制造即沸腾炉中黄铁矿燃烧的化学方程式______.

(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
A、精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图1所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是______、______.
B、接触室中2SO2(g)+O2(g)
2SO3(g),反应过程的能量变化如图2所示.催化剂 . △
已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
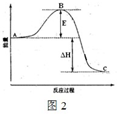
①图中C点表示______,E的大小对该反应的反应热______(填“有”或“无”) 影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”或“降低”).
②反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”);图中△H=______kJ•mol-1.
(3)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物.取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收.实验数据如下:
| 实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
| 第一次 | 1.570 | 0.340 |
| 第二次 | 3.140 | 0.680 |
| 第三次 | 4.710 | 0.510 |
| 第四次 | 6.280 | 0 |
②x的值为______.
(1)根据反应原料写出化学方程式4FeS2+11O2
2Fe2O3+4SO2,故答案为4FeS2+11O2 高温 .
2Fe2O3+4SO2 高温 .
(2)①E为活化能,不影响化学反应能量,加入催化剂可改变反应历程并降低活化能.
②K只与温度相关的函数,升高温度,由于本反应为放热反应,平衡向逆移动,故K减小;图中表示的是反应2SO2(g)+O2(g)
2SO3(g),表示2mol二氧化硫反应放出的热量,已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1,所以图中的焓变为99kJ•mol-1×2=198KJ•mol-1,催化剂 . △
故答案为:①生成物能量,无,降低.②,减小,-198.
(3)本反应历程是:OH-首先是和NH4HSO3中的H+反应,随后有多的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO3的量也增大,放出的氨气的量会为0.浓硫酸增加的质量就是氨气的质量.第一次和第二次放出的氨气的量是一样的,所以说第一次肯定是OH-的量过量.利用第二次的量计算(因为是OH-不足).
设:(NH4)2SO3的物质的量为a,NH4HSO3的物质的量为b
116a+99b=3.140(质量守恒)…①
17(2a+b)=0.680(元素守恒)…②
解得a=0.010mol,b=0.020mol,即(NH4)2SO3和NH4HSO3的物质的量之比为1:2.
再根据(NH4)2SO3~2NaOH,NH4HSO3~NaOH,可算出x=1.2mol/L.
故答案为:①1:2.②1.2.
