问题
选择题
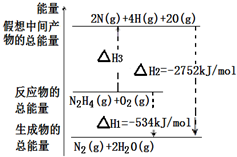
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是( )
A.194
B.391
C.516
D.658
答案
根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol-534kJ/mol=2218kJ/mol,
设断裂1molN-H键所需的能量为K,即154+4K+500=2218,解得K=391.
故选B.
