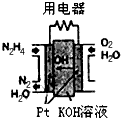
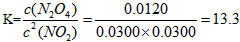肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料。请回答下列问题
(1)直接肼燃料电池原理如图所示,通入N2H4的极为电池的__________极。(填:正、负)
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7kJ·mol-1
N2O4(g) △H=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:_____________________。
(3)肼的水合物(水合肼,N2H4·2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下
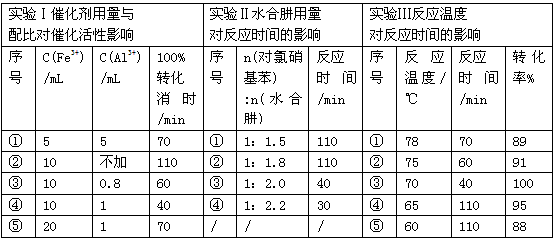
请分别从实验Ⅰ、Ⅱ、Ⅲ组合出最佳条件依次为_________________(选用序号①②③④⑤)。
(4)已知:2NO2(g)==N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应
2NO2(g)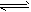 N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(5)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、
c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)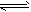 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
_______________________________
(1)负极
(2)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947 .6 kJ· mol-1
(3)④④③
(4)BC
(5)