问题
填空题
(14分)
某氮肥厂氨氮废水中的氮元素多以NH4+和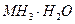 的形式存在,该废水的处理流程如下:
的形式存在,该废水的处理流程如下:

(1) 过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用: 。
②用化学平衡原理解释通空气的目的: 。
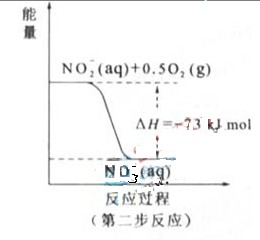
(2) 过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成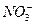 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
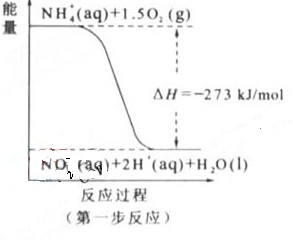
①第一步反应是 反应(选题“放热”或“吸热”),判断依据是 。
②1mol NH4+(aq)全部氧化成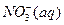 的热化学方程式是 。
的热化学方程式是 。
(3) 过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗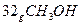 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
答案
(1)①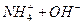

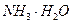
②废水中的NH3被空气带走,使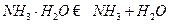 D的平衡向正反应方向移动,利于除氨
D的平衡向正反应方向移动,利于除氨
(2)①放热
△H=-273kJ/mol<0(反应为的总能量大于生成物的总能量)
②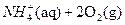

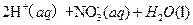
△ H=-346kJ/mol
③5:6
