问题
计算题
向8 g某+2价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗的硫酸体积为100 mL,在所得溶液中插入铂电极进行电解,一定时间后,在一个电极上收集到标准状况下224 mL氧气,在另一个电极上得到1.28 g金属。
(1)根据计算确定金属的名称。
(2)计算通电后所得硫酸溶液的物质的量浓度(溶液体积按100 mL计算)。
答案
(1)设+2价金属为M,因n(O2)=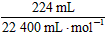 =0.01 mol,根据:2M~4e-~O2可知,M的物质的量
=0.01 mol,根据:2M~4e-~O2可知,M的物质的量
0.02 mol,其摩尔质量为1.28 g/0.02 mol=64 g·mol-1,则金属为铜。
(2)依Cu~H2SO4得:n(H2SO4)=0.02 mol。故c(H2SO4)=0.02 mol/0.1 L=0.2 mol·L-1。
